氯化鈣
| 氯化鈣 | |
|---|---|
 |
|
 |
|
| IUPAC名 氯化鈣 |
|
| 別名 | 氯化鈣 E509 |
| 識別 | |
| CAS號 | 10043-52-4 10043-52-4 (無水) 22691-02-7 (一水合物) 10035-04-8 (二水合物) 25094-02-4 (四水合物) 7774-34-7 (六水合物) |
| PubChem | 24854 |
| ChemSpider | 23237 |
| SMILES |
|
| InChI |
|
| InChIKey | UXVMQQNJUSDDNG-NUQVWONBAG |
| EINECS | 233-140-8 |
| ChEBI | 3312 |
| RTECS | EV9800000 |
| DrugBank | DB01164 |
| ATC代碼 | A12AA07,B05, G04 |
| 性質 | |
| 化學式 | CaCl2 |
| 摩爾質量 | 110.98 g/mol(無水) 128.999 g/mol(一水合物) 147.014 g/mol(二水合物) 183.045 g/mol(四水合) 219.08 g/mol(六水合物) g·mol⁻¹ |
| 外觀 | 白色粉末 易潮解 |
| 氣味 | 無臭 |
| 密度 | 2.15 g/cm3(無水) 1.835 g/cm3(二水合物) 1.83 g/cm3(四水合物) 1.71 g/cm3(六水合物) |
| 熔點 | 772 °C(無水) 260 °C(一水合物) 176 °C(二水合物) 45.5 °C(四水合物) 30 °C(六水合物)[1] |
| 沸點 | 1935 °C (無水) |
| 升華熱 | 317.6 [2]KJ/mol |
| 溶解性(水) | 74.5 g/100mL (20 °C) 59.5 g/100 mL (0 °C) |
| 溶解性 | 溶於丙酮、乙酸 |
| pKa | 8-9(無水) 6.5-8.0(六水合物) |
| 折光度n D |
1.52 |
| 結構 | |
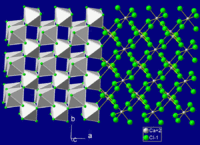
| 晶體結構 | 正交晶系(變形金紅石),oP6 六方晶系(六水合物)[3] |
| 空間群 | Pnnm, No. 58 |
| 配位幾何 | 正八面體,6配位[4] |
| 危險性 | |
| 歐盟危險性符號 |
|
| 警示術語 | R:R36 |
| 安全術語 | S:S2, S22, S24 |
| 歐盟編號 | 017-013-00-2 |
GHS危險性符號 |
|
| H-術語 | H319, H316, H302 |
| P-術語 | P264, P280, P270, P305+351+338, P337+313, P301+312, P330, P501 |
| NFPA 704 | |
| LD50 | 1000 mg/kg (口服,小鼠) |
| 相關物質 | |
| 其他陰離子 | 氟化鈣 溴化鈣 碘化鈣 |
| 其他陽離子 | 氯化鈹 氯化鎂 氯化鍶 氯化鋇 氯化鐳 |
| 若非註明,所有數據均出自一般條件(25 ℃,100 kPa)下。 | |
化學及物理性質
由於氯化鈣可溶於水,故可作為溶液中鈣離子的來源。這個性質使得它能用於置換溶液中的某些特定離子。比如溶液中的磷酸根就能用氯化鈣置換為氯離子:- 3CaCl2(aq) + 2K3PO4(aq) → Ca3(PO4)2 (S) + 6KCl (aq)
- CaCl2 → Ca(s) + Cl2(g)↑
無水氯化鈣和除六水合物外的水合物都是有潮解性的白色固體,當氯化鈣的晶體結構中積累足夠多的水分後固體自身就會溶解形成溶液。
氯化鈣溶液能誘導肌動蛋白單體發生聚合,且肌動蛋白單體開始發生聚合的臨界濃度與氯化鈣溶液的濃度呈反曲函數關係。肌動蛋白受誘導聚合的具體機理與鈣離子和蛋白多個特定部位的結合有關[8]。六水氯化鈣加熱至200℃失水變成二水合物,繼續加熱,到260℃完全脫水,產生白色多孔的氯化鈣。由於加熱過程中伴有少許水解反應,因此無水氯化鈣常含有微量的氧化鈣[5]。
對1M、2M和4M氯化鈣水溶液的X射線衍射發現溶液中的鈣離子和氯離子可被看做是相互獨立的水合離子,大部分情況下是由六個水分子與一個鈣離子或氯離子配位構成一個水合外層,形成八面體構型的水合離子。[4]水合鈣離子中鈣離子與水分子間的距離為2.40-2.45Å,水合氯離子中氯離子與水分子間的距離為3.10-3.20Å。[4]與氯化鈣的水溶液不同,對液態六水合氯化鈣的X射線衍射研究顯示雖然Ca2+和Cl-與水分子之間存在水合作用,但六水合氯化鈣作為晶態固體而具有的長程有序結構在變成液態後未被完全打破。[3]處在三維坐標軸原點的Ca2+被三個分別處在(u,O,O), (0,u,0)和(
 ,
, ,0)位置上的水分子所包圍,這三個水分子與Ca2+的距離約為2.4Å,還有六個水分子分別處在(v,0,½)、(0,v,½)、(
,0)位置上的水分子所包圍,這三個水分子與Ca2+的距離約為2.4Å,還有六個水分子分別處在(v,0,½)、(0,v,½)、( ,
, ,½)(v,0,
,½)(v,0, )、(0,v,
)、(0,v, )和(
)和( ,
, ,
, ),它們距離鈣離子約2.7Å,這六個水分子沿c軸方向形成Ca—H2O—Ca的長鏈,鏈上兩個相鄰Ca2+間的距離約為4Å;Cl-置於兩條平行鏈之間,在每個氯離子周圍有六個水分子,其中三個水分子與氯離子間的距離約為3.2Å,餘下三個與氯離子間的距離約為3.6Å。[3]
),它們距離鈣離子約2.7Å,這六個水分子沿c軸方向形成Ca—H2O—Ca的長鏈,鏈上兩個相鄰Ca2+間的距離約為4Å;Cl-置於兩條平行鏈之間,在每個氯離子周圍有六個水分子,其中三個水分子與氯離子間的距離約為3.2Å,餘下三個與氯離子間的距離約為3.6Å。[3]製備
它是製備碳酸鈉的索爾維法的副產品:- Ca(OH)2 + 2 NH4Cl → CaCl2 + 2 NH3 + 2 H2O
- CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + CO2(g) + H2O (l)
分布
二水合氯化鈣構成了稀有的蒸發岩礦物水氯鈣石[12][13],蒸發岩礦物南極石則是以礦物形式存在於自然界中的六水合氯化鈣[14],其他與氯化鈣有關的礦物包括同樣非常稀有的氯鉀鈣石KCaCl3[15][16]。應用
乾燥劑
顆粒狀的無水氯化鈣常作為乾燥劑填充乾燥管[17],用氯化鈣乾燥過的巨藻(或稱海草灰)可用於純鹼的生產。一些家用除濕器比如DampRid[18]會使用氯化鈣吸收空氣中的水分。氯化鈣還可作為氣體和有機液體的乾燥劑或脫水劑。由於氯化鈣是中性的,因此它可以乾燥酸性或鹼性的氣體和有機液體,可也在實驗室製取少量氣體如氮氣、氧氣、氫氣、氯化氫、二氧化硫、二氧化碳、二氧化氮等時乾燥這些制出的氣體。但不能用來乾燥乙醇和氨,因為乙醇和氨氣分別會與氯化鈣反應生成醇合物CaCl2·4C2H5OH和氨合物CaCl2·8NH3[19][5]。無水氯化鈣還可被製成家用產品用作空氣吸濕劑,無水氯化鈣作為吸水劑已被FDA批准用於包紮急救,它的作用是確保創口處的乾燥[20]。將無水氯化鈣鋪撒在沙石路面上,利用無水氯化鈣的吸濕性在空氣濕度低於露點時凝結空氣中的濕氣以保持道路表面的濕潤,藉此控制道路上灰塵的揚起。[21][22]
醫學和生物學的應用
在生物學和醫學的研究中,氯化鈣廣泛應用於配製生物醫學實驗所需的緩衝液,比如在研究一種針對鉀離子通道複合物的新型激活劑時加入CaCl2配製用於被分離的卵母細胞的ND96儲備液[23];在研究鳥苷醯環化酶C對中腦多巴胺神經元的功能時採用CaCl2進行腦片製備實驗[24];在研究細菌和古細菌中用於抵禦氟毒性的氟核糖開關時以1mmol/L濃度的CaCl2進行串聯標記實驗等[25]。在將目的基因導入受體細胞過程中,可以使用氯化鈣增加受體細胞膜的通透性,使得質體更容易地導入,這個方法是由史丹福大學的遺傳學家斯坦利·諾曼·科恩在1972年研究大腸桿菌時發現的。[26]
通過靜脈注射10%氯化鈣溶液可用於低鈣血症的治療,氯化鈣也能用於治療鎂中毒。通過心電圖測量發現注射氯化鈣溶液可對抗心臟毒性。在由高鉀血症引發血清鉀濃度過高的情況下,氯化鈣能起到保護心肌層、防止心律不齊的作用。氯化鈣作為美國醫院急救室的常備藥物,可用於快速治療鈣離子通道阻滯劑中毒(這種中毒可由服用預防心臟病的藥物地爾硫䓬產生的副作用引發)和由氫氟酸引起的中毒[27],但對黑寡婦蜘蛛叮咬引發的中毒無有效的解毒作用[28]。氯化鈣溴化鈉注射液在中國被國家食品藥品監督管理局批准作為水電解質調節藥使用[29]。
除冰劑和冷卻浴
氯化鈣能降低水的凝固點,在道路上鋪撒氯化鈣水合物能防止結冰和除冰融雪[30],但是冰雪融化後的鹽水會破壞沿路土壤和植被並使路面混凝土惡化[31]。氯化鈣溶液也能和乾冰混合後配製低溫冷卻浴。將棒狀乾冰分批加入到鹽水溶液中,直至體系中出現冰塊為止。不同種類和濃度的鹽溶液所能維持的冷卻浴穩定溫度會有所差別。一般常用氯化鈣為鹽原料,通過調節濃度來獲得所需的穩定溫度,不僅是因為氯化鈣廉價易得,而且因為氯化鈣溶液的共晶溫度(即溶液全部凝結形成顆粒狀的冰鹽粒子時的溫度)相當的低,能達到-51.0℃,這樣使得可調節的溫度範圍從0℃至-51℃[32]。該方法可以在能起到保溫效果的杜瓦瓶中實現,也可以在杜瓦瓶體積有限而同時又需要配製較多的鹽溶液時使用一般的塑料容器來盛裝冷卻浴,這種情況下溫度的維持同樣較為穩定。[32]
鈣離子的來源
游泳池水中添加氯化鈣可以使池水成為pH緩衝溶液同時增加池水硬度,這樣做可以較少池壁混凝土受到的侵蝕。根據勒夏特列原理和同離子效應,增加池水鈣離子濃度會減緩對混凝土結構必不可少的鈣化合物的溶解[33]。在海洋水族館的水中加入氯化鈣能增加水中生物可利用鈣的含量,水族館中所養殖的軟體動物和腔腸動物會利用它來形成碳酸鈣的外殼。雖然用氫氧化鈣或鈣反應器也能達到同樣的目的,但相比之下加入氯化鈣是最快的方法也是對水的pH值影響最小的。
食品
作為一種食品配料,氯化鈣可起到多價螯合劑和固化劑的作用,它已被歐盟批准為允許作為食品添加劑使用,E編碼為E509[34]。被美國食品藥品監督管理局認為是「通常確認為是安全的物質」(Generally recognized as safe,縮寫為GRAS)[35]。據估計每人每天攝入的氯化鈣食品添加劑有160至345毫克[36]。氯化鈣作為固化劑,可用於蔬菜罐頭。它還能使大豆凝乳固化形成豆腐,又能作為烹飪分子美食的原料通過與海藻酸鈉反應使蔬菜和水果汁表面膠化形成類似魚子醬狀的小球[37][38][39]。作為電解質添加到運動飲料或一些軟飲料包括瓶裝水中。由於氯化鈣本身有非常強的鹹味所以可代替食鹽用於腌黃瓜的製作同時又不增加食物鈉含量的效果。氯化鈣可降低冰點的屬性在填充有焦糖的巧克力棒中被用來延緩焦糖的凍結。
在缺乏礦物質的啤酒釀造液中會加入氯化鈣,因為鈣離子是啤酒釀造過程中最具影響性的礦物質之一,它會影響麥芽汁的酸性並對酵母作用的發揮起到影響。[40]而且氯化鈣能給釀造出的啤酒帶來甜味。[41]
其他方面
水合氯化鈣固體可作為相變儲能材料使用。比如六水合氯化鈣由於熔點為30℃、熔化熱(即物質從固相轉變為同溫度的液相過程中所吸收的熱量)達到190 KJ/mol[42],故可作為中低溫用於工業餘熱回收、太陽輻射熱量的吸收利用[43][44],但是它同所有的無機水合鹽類相變材料類似,存在過冷嚴重的問題(其過冷度達20°C),需要加入添加成核劑克服[45]。氯化鈣在混凝土中起到幫助加快初始設定的效果,但氯離子會引起鋼筋腐蝕,所以氯化鈣不能用於鋼筋混凝土[46]。無水氯化鈣因其吸濕性可以給混凝土提供一定程度的水分。[47]
氯化鈣也是塑料和滅火器[48][49]中的添加劑,在廢水處理作為助濾劑,在高爐中作為添加劑來控制原料的聚集和粘附從而避免爐料沉降,在織物軟化劑中起到稀釋劑的作用。[50]
氯化鈣溶解放熱的性質使得它用在自加熱罐頭和加熱墊上。
石油工業中,氯化鈣用於增加無固相鹽水的密度,也能加在乳化鑽井液的水相中用來抑制粘土的膨脹。作為助熔劑在戴維法電解熔融氯化鈉生產金屬鈉的過程中作為助熔劑起到降低熔點的作用。製作陶瓷時會將氯化鈣作為材料成分之一,它會使黏土顆粒在溶液中懸浮,這樣注漿時陶土顆粒用起來更容易。


沒有留言:
張貼留言